在復雜的腸道微生物群落中,細菌種群之間的競爭決定著生態位的穩定與優勢。Ⅵ型分泌系統(Type VI secretion system, T6SS)是革蘭氏陰性菌中一種普遍存在的分泌裝置,能夠以接觸依賴的方式將毒性效應蛋白注入競爭菌體,從而實現“同類廝殺”與生態主導。盡管已有研究揭示T6SS可裝載多種類型的效應分子,但這些效應蛋白在同一次分泌事件中是否可以被協同裝載、如何識別與釋放、又如何實現功能協同,長期以來一直未有清晰的分子機制。本研究以人腸道共生菌 Bacteroides fragilis GS086 為模型,揭示了兩種效應蛋白BtpeA與BtaeB在一個新的適配蛋白BtapC的協調下被協同分泌的完整過程,解析了四元復合物VgrG–BtpeA–BtaeB–BtapC的冷凍電鏡結構,并闡明了其在腸道菌群競爭中的功能意義。這一發現不僅揭示了Bacteroidota門細菌T6SS系統的特殊演化模式,也為理解多效應蛋白共分泌提供了新的理論框架。

B. fragilis GS086中T6SS V2 基因座攜帶兩種對種間競爭關鍵的效應因子
研究首先通過對B. fragilis GS086中T6SS V2位點的基因組比對發現,該區域包含兩個潛在效應基因btpeA與btaeB,以及一個未注釋的基因btapC。野生型菌株在與受體菌Bacteroides xylanisolvens共培養時表現出強烈的殺傷作用,而刪除btpeA、btaeB或btapC中的任意一個基因后,殺傷作用完全喪失,與T6SS失活突變株相似。這一現象表明,三者之間存在功能依賴關系。進一步的免疫印跡實驗顯示,BtpeA與BtaeB的分泌均依賴T6SS核心成分Hcp,且在受體菌周質中過表達會導致明顯的細胞腫脹與裂解現象。相關檢測均使用了AtaGenix提供的兔多克隆抗體(anti-BtpeA、anti-BtaeB、anti-BtapC、anti-Hcp1),通過 Western 免疫印跡實驗,以胞質蛋白 DnaK為內參對照,清晰區分了全細胞裂解液與培養上清中目標蛋白的分布,準確驗證了 BtpeA、BtaeB 的 T6SS 依賴性分泌特性。
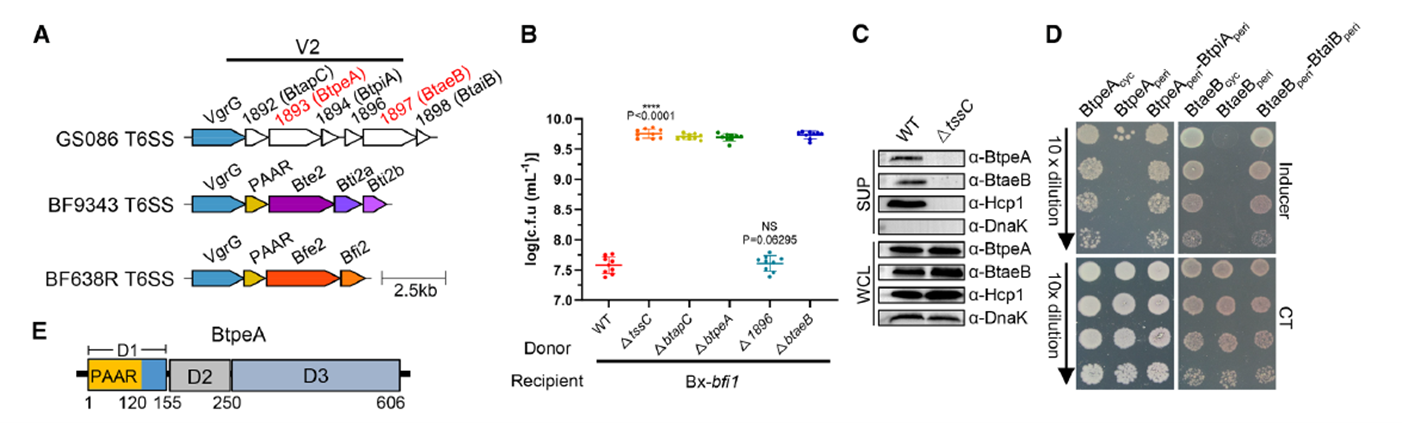
Figure 1. 兩個相鄰的T6SS效應物位點檢測
BtpeA與BtaeB為功能不同但均能破壞細胞壁的酶
結構和生化分析進一步揭示了兩種效應蛋白的功能特征。BtpeA含有一個PAAR結構域和兩個未注釋功能域,其C端D3結構域與大腸桿菌ColM磷酸酶高度同源,可催化細胞壁前體分子Lipid II的去磷酸化反應,從而阻斷肽聚糖的合成。BtaeB則包含一個N端結構域和一個屬于C39家族的C端酰胺酶結構域,通過Cys460和His546活性位點切割肽聚糖四肽交聯,直接破壞細胞壁。兩者分別從細胞壁合成與降解兩端發起攻擊,形成互補的破壞模式。作者還發現BtpeA和BtaeB的分泌呈現顯著的互相依賴性:當刪除其中一個效應基因時,另一種蛋白的分泌完全被抑制,而細胞內表達水平并未受到影響。這種互依關系提示它們可能被作為一個整體加載到T6SS的VgrG裝置上。
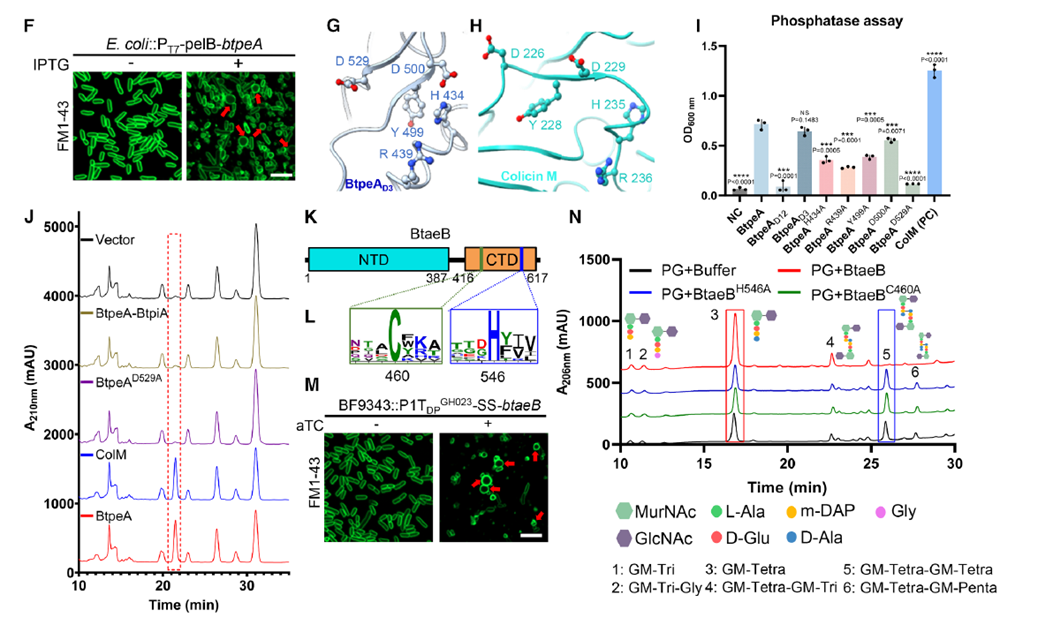
Figure 2. 細胞壁破壞性T6SS效應物對物種間競爭至關重要
BtpeA與BtaeB的T6SS介導分泌具有相互依賴性
為了尋找支撐這一協同分泌現象的分子基礎,研究者重點關注了位于同一基因簇中的BtapC。刪除btapC不僅使BtpeA與BtaeB的分泌消失,也導致Hcp釋放減少,表明BtapC在整個T6SS系統的裝配中發揮核心作用。隨后通過Pull-down與免疫共沉淀實驗發現,BtapC可直接與BtpeA結合形成二元復合物,而BtaeB則只能在該二元復合物形成后再被招募,從而生成三元復合物BtpeA–BtaeB–BtapC。進一步的實驗顯示,這個三元復合物能夠與VgrG結合形成穩定的四元裝載復合體VgrG–BtpeA–BtaeB–BtapC。該結果在體內外均得到驗證,充分證明了BtapC作為“裝載適配器”的關鍵作用。實驗中,AtaGenix 的 anti BtapC 抗體 成功檢測到 BtapC 在復合物中的存在,結合 anti BtpeA、anti BtaeB、anti VgrG 抗體,明確了 BtapC 在復合物組裝中的銜接作用。

Figure 3. 三元復合物的形成由BtapC協調,并隨后裝載到VgrG上
VgrG-BtpeA-BtaeB-BtapC 四元復合物的冷凍電鏡結構與組裝機制
單顆粒冷凍電鏡對該四元復合物進行了高分辨率解析,分辨率達到3.06 Å,揭示了復雜而精密的分子裝配方式。BtapC呈現出開放貝殼狀構型,其結構空腔緊密包裹著BtpeA的N端α1–α4螺旋,并通過大量疏水與極性相互作用穩定結合。這一結構不僅奠定了BtpeA與BtapC的結合界面,也為后續BtaeB的裝載提供空間基礎。BtaeB在與BtpeA–BtapC復合物結合后,其β12片段發生顯著構象變化,使Lys188側鏈可同時與BtpeA的Asp148及BtapC的Ser127形成氫鍵橋,從而在三者之間建立穩定的連接網絡。點突變實驗驗證了這一關鍵氨基酸殘基對復合物形成的重要性。值得注意的是,在該復合物中,BtpeA的PAAR結構域通過VgrG尖端完成裝載,而BtaeB的存在是維持該過程穩定進行的必要條件。AtaGenix 的 anti BtpeA、anti BtapC 抗體 在此過程中準確識別不同截短體蛋白,為結構 - 功能關系驗證提供了特異性檢測工具。
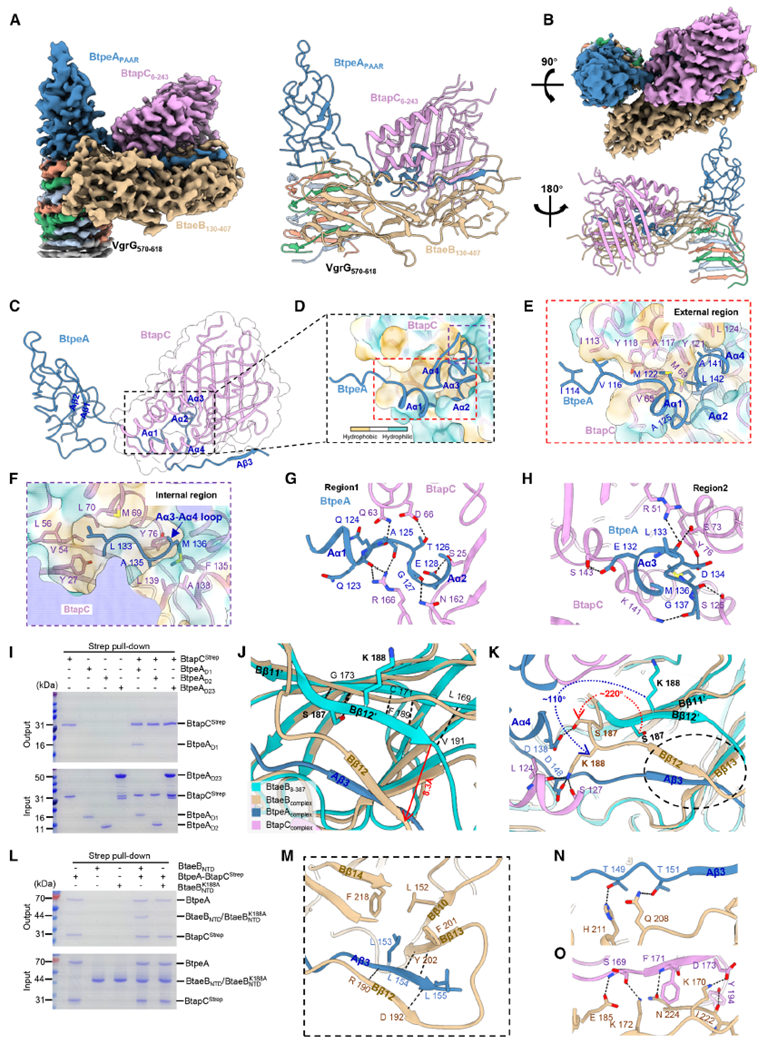
Figure 4. VgrG-BtpA-BtaeB-BtapC復合體的結構
BtaeB 的保守環結構對 BtpeA 與 BtaeB 共分泌至關重要
在進一步的結構分析中,作者在BtaeB的C端發現了一段獨特的短環(殘基400–407),其電子密度位于VgrG與BtpeA PAAR界面的結合面上。這一環狀結構嵌入VgrG–BtpeA之間的三角區域,形成多重氫鍵與疏水作用,起到穩定復合體的“鎖鍵”作用。功能驗證表明,保留該環的BtaeB突變株能夠正常分泌BtpeA與Hcp,而刪除該環則完全喪失分泌能力。由此可以確定,這段短環是驅動雙效應蛋白協同裝載的結構檢查點(checkpoint),確保兩種效應分子在每次T6SS發射事件中被同步注入受體菌。
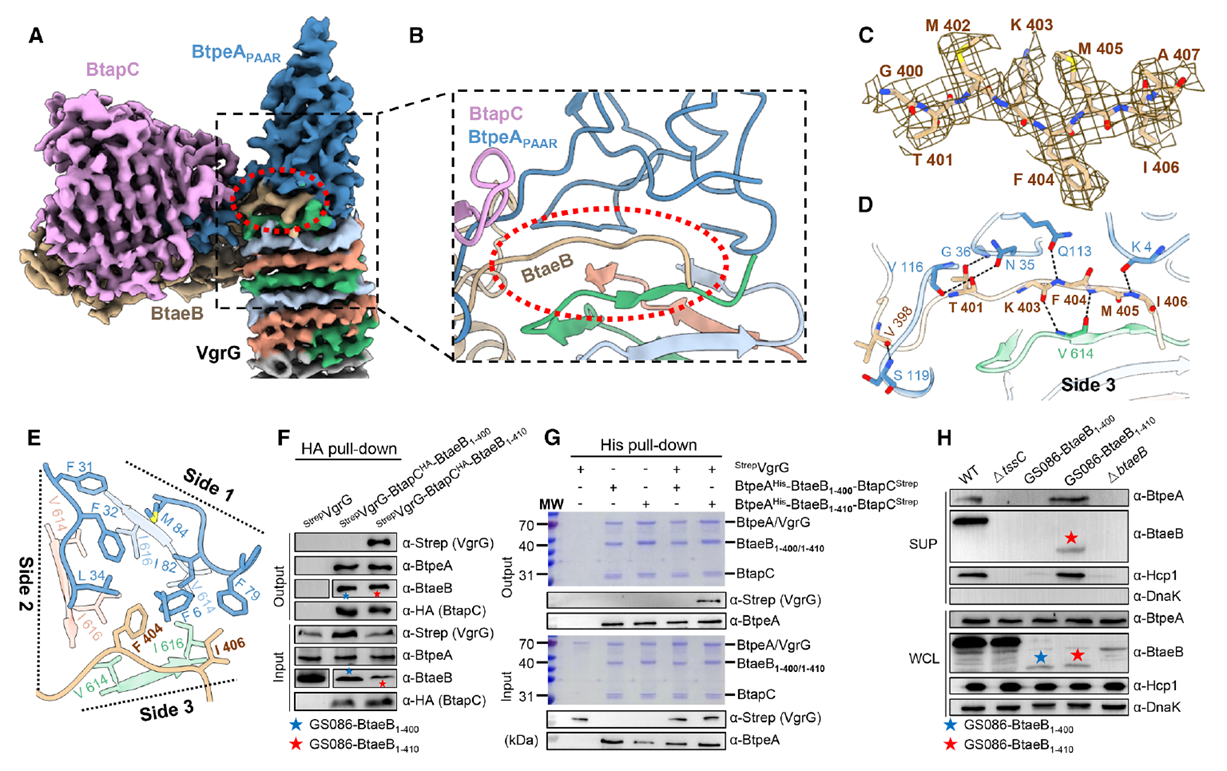
Figure 5. BtaeB衍生的環對BtpeA和BtaeB的共分泌至關重要
共分泌的 BtpeA 與 BtaeB 協同提升脆弱擬桿菌的腸道適應性
動物實驗進一步驗證了這種協同分泌在生態競爭中的生理意義。研究者將野生型及不同突變株分別與敏感菌株共定植于抗生素處理后的無菌小鼠腸道中。結果顯示,單獨失活BtpeA的菌株對受體的競爭力下降約10³倍,而單獨失活BtaeB或完全缺失T6SS的菌株幾乎喪失競爭能力。相比之下,野生型菌株能將受體菌豐度降低約10?倍,說明BtpeA與BtaeB在腸道環境中表現出顯著的協同毒性。也就是說,BtpeA阻斷細胞壁修復,而BtaeB直接切割肽聚糖交聯,兩者聯合造成不可逆的細胞壁崩解,從而賦予菌株更強的腸道定殖優勢。生物信息學分析顯示,這種BtapC介導的雙效應蛋白共分泌機制在Bacteroidota門中普遍存在,約50%的B. fragilis菌株攜帶類似的結構模塊,提示該系統在腸道細菌進化中具有高度保守性與適應性。

Figure 6. BtapC介導的效應物共分泌在小鼠中產生功能協同作用,并且很可能在人類腸道擬桿菌門中得到保留
總體來看,該研究首次系統性地揭示了腸道共生菌中一種獨特的T6SS協同分泌模式:BtapC作為核心適配器,通過與BtpeA形成初級復合物并依次招募BtaeB,使兩種結構與功能互補的效應蛋白能夠在同一次T6SS發射中共同被注入競爭菌體。BtaeB末端短環插入VgrG–BtpeA結合界面,形成裝載“鎖鍵”,確保整個四元復合物的穩定裝配與同步分泌。這一機制不僅實現了結構層面的多效應協同,還通過功能互補顯著增強了菌株在腸道生態中的競爭力。更值得注意的是,這一發現揭示了T6SS可能具備“模塊化裝配”的潛力,即通過保守的裝載骨架結合可變的毒性模塊,實現對不同環境的定向適應。借助AtaGenix提供的多克隆抗體體系(anti-BtpeA、anti-BtaeB、anti-BtapC、anti-Hcp1),研究者得以精準追蹤復合物的形成與分泌過程,為T6SS結構與功能研究提供了強有力的工具支持。未來,類似的裝載策略或可被人工改造,用于開發針對特定腸道菌群的微生態干預技術,甚至為抗耐藥細菌的新型精準殺菌系統提供設計模板。
截止至2025.10.14,400余篇文獻引用了普健生物的一站式蛋白抗體開發技術服務。展望未來,普健生物將繼續支持科研創新。為感謝持續支持,普健生物提供高質量服務,并長期開展文獻獎勵活動。凡在論文中引用普健生物技術服務并標注:
中文:普健生物(武漢)科技有限公司
英文:AtaGenix Laboratories Co., Ltd.(Wuhan), Wuhan, PR China
均可獲得專屬獎勵。
發表刊物
SCI期刊雜志
- IF≥15.0:最高3000元普健全系產品抵扣券或最高1500元京東購物卡
- 10≤IF<15:最高3000元普健全系產品抵扣券或最高1000元京東購物卡
- 5.0≤IF<10:最高800元普健全系產品抵扣券或最高600元京東購物卡
- 3.0≤IF<5.0:最高600元普健全系產品抵扣券或最高200元京東購物卡
更多技術服務與合作咨詢
歡迎聯系:info@atagenix.com 或撥打電話 027-87001869 獲取專屬服務方案

 聯系我們
聯系我們





