胃癌(gastric cancer, GC)是全球第五大常見惡性腫瘤和第四大癌癥相關(guān)死亡原因,其治療面臨的主要挑戰(zhàn)是化療耐藥性,特別是對奧沙利鉑(oxaliplatin, OXA)的耐藥。OXA作為GC的一線化療藥物,耐藥機制復(fù)雜,涉及表觀遺傳調(diào)控的非突變性異常和代謝重編程,如Warburg效應(yīng)導(dǎo)致的糖酵解增強和乳酸過度產(chǎn)生。近年來,乳酸被重新定義為重要的表觀修飾物,通過組蛋白和非組蛋白乳酰化影響感染和癌癥的病理過程。然而,在GC中的乳酰化修飾,尤其是其在OXA耐藥中的作用仍未充分闡明。同時,長非編碼RNA(LncRNA)作為關(guān)鍵表觀調(diào)控因子,通過調(diào)控能量代謝影響GC耐藥性,但具體機制不明。
江南大學(xué)附屬醫(yī)院的研究團隊發(fā)表于Free Radical Biology and Medicine的研究整合多組學(xué)分析和類器官模型,發(fā)現(xiàn)LncRNA BASP1-AS1驅(qū)動Poly(RC)-binding protein 2(PCBP2)K115位點乳酰化(PCBP2K115la),抑制鐵死亡(ferroptosis),從而賦予GC細(xì)胞OXA耐藥性。機制上,BASP1-AS1募集Unc-51 Like Autophagy Activating Kinase 1(ULK1)和乳酸脫氫酶A(LDHA)復(fù)合體,促進(jìn)LDHA磷酸化增強糖酵解和乳酸產(chǎn)生;乳酸誘導(dǎo)PCBP2K115la阻斷其與ARIH2的相互作用,抑制泛素化降解穩(wěn)定PCBP2,同時通過組蛋白H3K14la轉(zhuǎn)錄激活LDHA/PCBP2,形成自放大代謝-表觀回路。該軸抑制鐵死亡維持耐藥,提供克服GC OXA耐藥的新靶點。
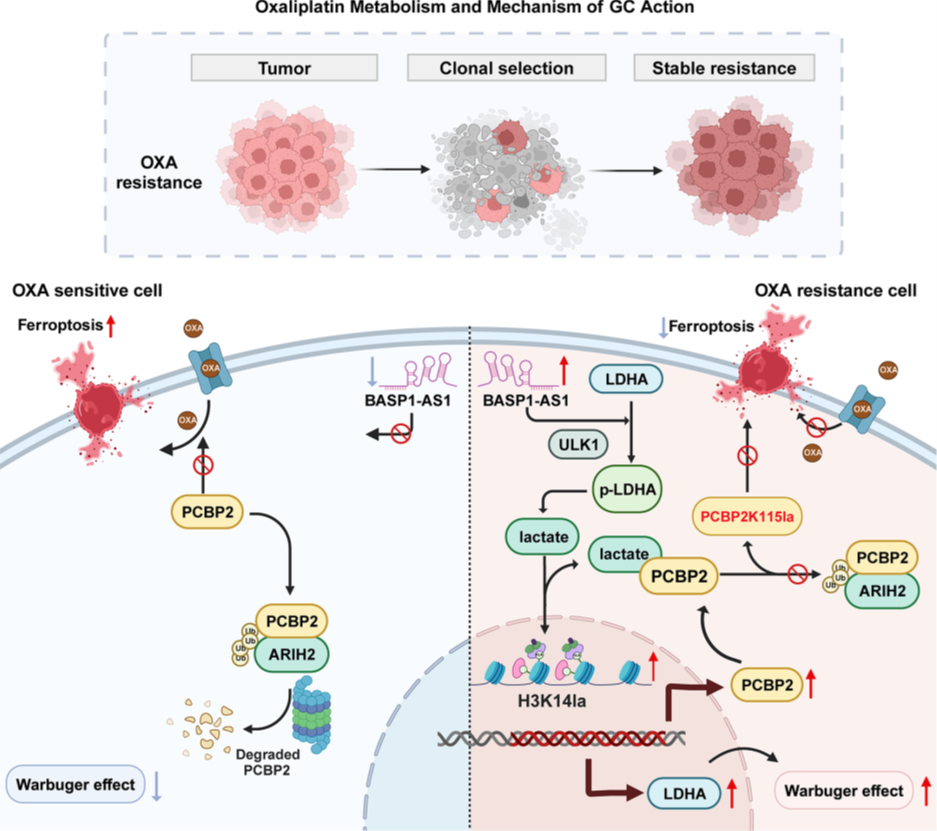
Figure 1.信號通路圖
乳酸誘導(dǎo)的PCBP2上調(diào)賦予GC細(xì)胞OXA耐藥性
為揭示GC中OXA耐藥機制,作者建立了OXA耐藥細(xì)胞系(AGSR, MKN45R)并與敏感親本系(AGSWT, MKN45WT)進(jìn)行多組學(xué)分析。CCK-8實驗驗證耐藥細(xì)胞IC50顯著升高。轉(zhuǎn)錄組和蛋白組學(xué)顯示耐藥細(xì)胞中無氧糖酵解和鐵死亡相關(guān)通路富集,提示代謝重編程抑制鐵死亡。乳酸產(chǎn)生和細(xì)胞外酸化率測定證實耐藥細(xì)胞糖酵解活性提升。WB顯示耐藥細(xì)胞蛋白乳酰化整體上調(diào),全蛋白乳酰化測序結(jié)合差異表達(dá)蛋白和鐵死亡相關(guān)蛋白交集分析鑒定PCBP2為關(guān)鍵候選:其在耐藥細(xì)胞中轉(zhuǎn)錄和蛋白水平過表達(dá),并受乳酰化調(diào)控。WB確認(rèn)PCBP2在耐藥系中上調(diào),KEGG分析顯示乳酸合成通路富集,外源乳酸劑量依賴性誘導(dǎo)PCBP2上調(diào)。慢病毒介導(dǎo)的PCBP2敲低和過表達(dá)經(jīng)WB驗證,功能實驗顯示敲低降低OXA耐藥性(增強化療敏感性),過表達(dá)增強耐藥性;凋亡實驗顯示敲低增加細(xì)胞死亡,但過表達(dá)無顯著變化。這些結(jié)果確立PCBP2為OXA耐藥關(guān)鍵調(diào)控因子,其抑制通過誘導(dǎo)凋亡恢復(fù)敏感性。

Figure 2. 乳酸誘導(dǎo)的PCBP2上調(diào)導(dǎo)致GC細(xì)胞對OXA具有抗性
PCBP2K115乳酰化通過阻斷ARIH2介導(dǎo)的泛素化賦予OXA耐藥性
為探究耐藥細(xì)胞中PCBP2異常升高的原因,研究者首先對全蛋白進(jìn)行乳酰化組學(xué)分析,結(jié)果發(fā)現(xiàn)大量差異乳酰化蛋白集中于鐵死亡通路。進(jìn)一步篩查到PCBP2的關(guān)鍵鐵結(jié)合位點K115,以及同位點的PCBP1 K115和GCLM K45均發(fā)生乳酰化。隨后的IP與WB實驗顯示,耐藥細(xì)胞中PCBP2的泛素化水平顯著下降,而其K115乳酰化修飾明顯增強。為了驗證二者的關(guān)系,研究者將K115突變?yōu)榫彼幔↘115R),結(jié)果發(fā)現(xiàn)該突變可阻斷乳酰化并促進(jìn)PCBP2的泛素化,提示乳酰化與泛素化在該位點存在互斥調(diào)控。為尋找負(fù)責(zé)這一調(diào)控的E3連接酶,團隊通過Co-IP與質(zhì)譜聯(lián)合分析繪制了PCBP2的E3網(wǎng)絡(luò),并鎖定ARIH2為關(guān)鍵候選。結(jié)構(gòu)模擬與結(jié)合實驗進(jìn)一步證實了PCBP2與ARIH2的直接互作。在耐藥細(xì)胞中,二者結(jié)合更為緊密,而敲低ARIH2會導(dǎo)致PCBP2泛素化水平下降。值得注意的是,K115R突變不僅增強了PCBP2與ARIH2的結(jié)合,也擺脫了乳酸代謝對其調(diào)控的依賴。這些結(jié)果定位K115為構(gòu)象開關(guān):乳酰化空間位阻阻斷ARIH2介導(dǎo)泛素化,穩(wěn)定PCBP2促進(jìn)OXA耐藥,揭示代謝-表觀串?dāng)_。
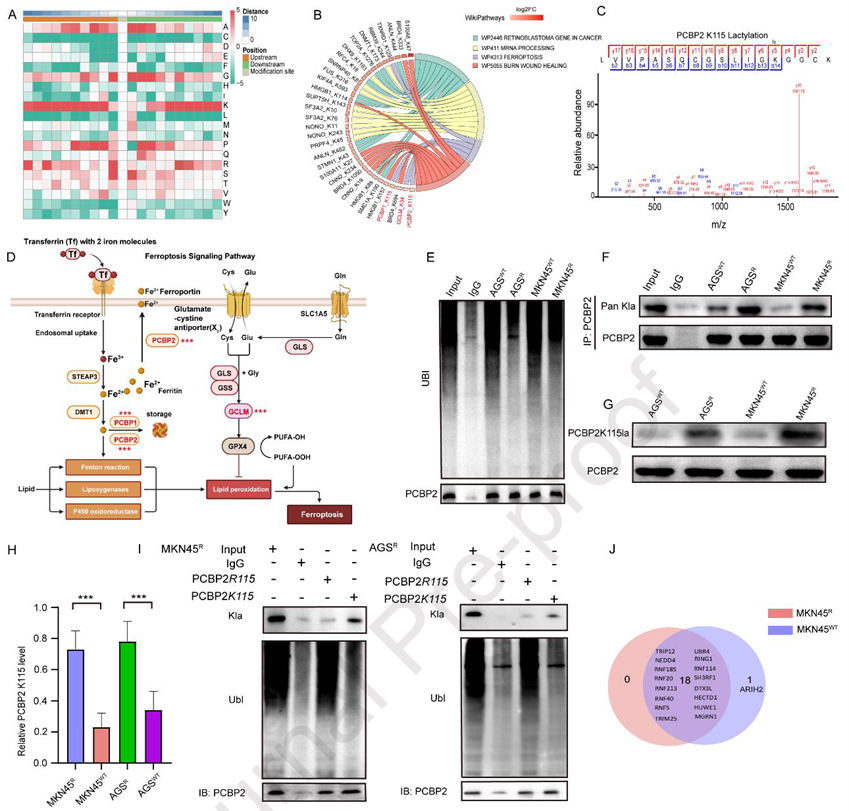
Figure 3. PCBP2K115乳酰化通過阻斷ARIH2介導(dǎo)的泛素化賦予OXA耐藥性
PCBP2在GC患者來源類器官模型中賦予OXA耐藥性
為驗證PCBP2在臨床中的作用,研究者建立了GC患者來源類器官(PDOs),H&E染色證實其保留原腫瘤結(jié)構(gòu)。長期監(jiān)測發(fā)現(xiàn),不同患者PDOs在OXA處理下呈現(xiàn)生長差異,CCK-8檢測進(jìn)一步揭示個體間對OXA的響應(yīng)性不一,與臨床療效一致。蛋白檢測顯示,PCBP2表達(dá)與耐藥指數(shù)呈正相關(guān),耐藥PDOs中水平更高。乳酸刺激可劑量依賴性上調(diào)患者#2和#3的PCBP2表達(dá),而慢病毒敲低PCBP2降低、過表達(dá)則增強OXA耐藥性;同時,糖酵解抑制劑2-DG可削弱耐藥表型。綜合結(jié)果表明,PCBP2不僅是OXA響應(yīng)的潛在預(yù)測標(biāo)志物,其調(diào)控受乳酸代謝顯著影響。
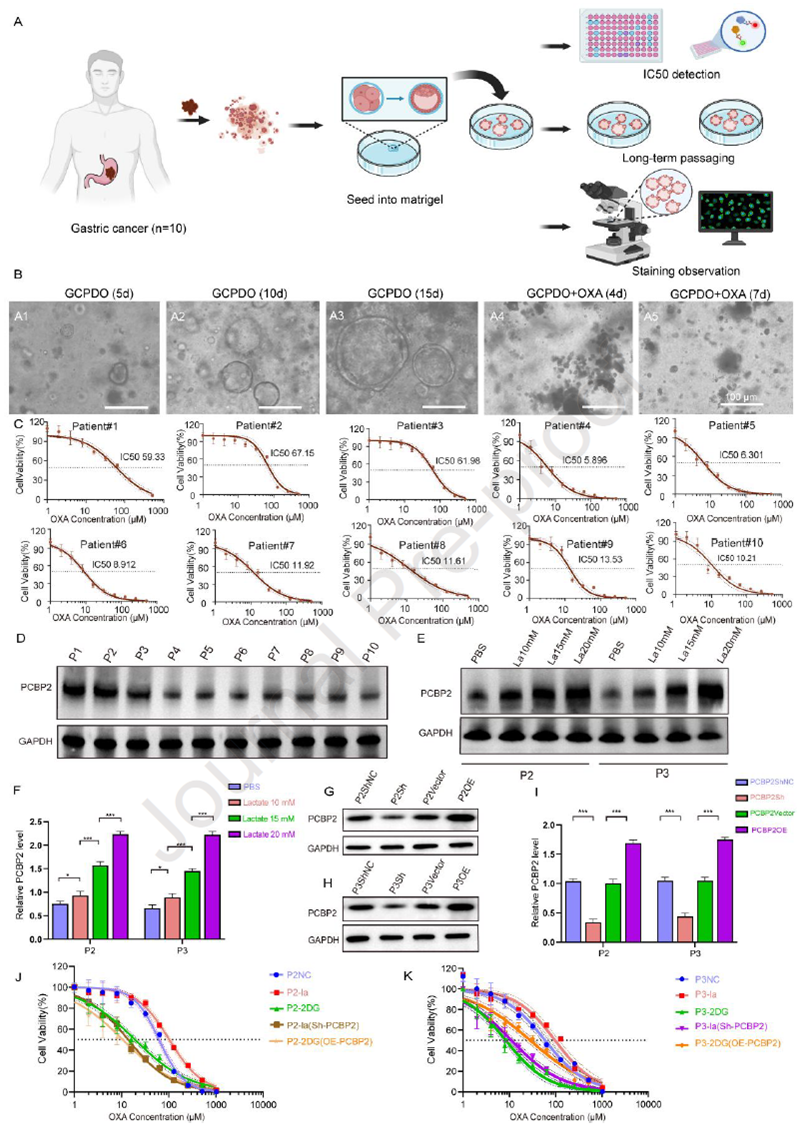
Figure 4. PCBP2在GC患者來源類器官模型中賦予OXA耐藥性
BASP1-AS1抑制鐵死亡并上調(diào)PCBP2表達(dá)
研究者發(fā)現(xiàn)鐵死亡過程與OXA敏感性密切相關(guān):鐵死亡抑制劑Fer-1可提高OXA IC50,而誘導(dǎo)劑RSL3則降低耐藥細(xì)胞的IC50。鑒于PCBP2在鐵死亡調(diào)控中的作用,進(jìn)一步聚焦其上游LncRNA。通過TCGA-STAD及轉(zhuǎn)錄組分析篩得4個候選LncRNA,其中BASP1-AS1在GC組織中高表達(dá)且與預(yù)后不良相關(guān)。qRT-PCR與FISH證實BASP1-AS1在耐藥細(xì)胞和高級別組織中升高,并與PCBP2共定位。功能實驗表明,敲低BASP1-AS1可降低PCBP2表達(dá),增強ROS積累與鐵死亡,抑制增殖并提高OXA敏感性;而過表達(dá)則產(chǎn)生相反效應(yīng)。結(jié)果揭示BASP1-AS1作為PCBP2的上游調(diào)控因子,通過抑制鐵死亡與凋亡維持OXA耐藥和腫瘤生長。
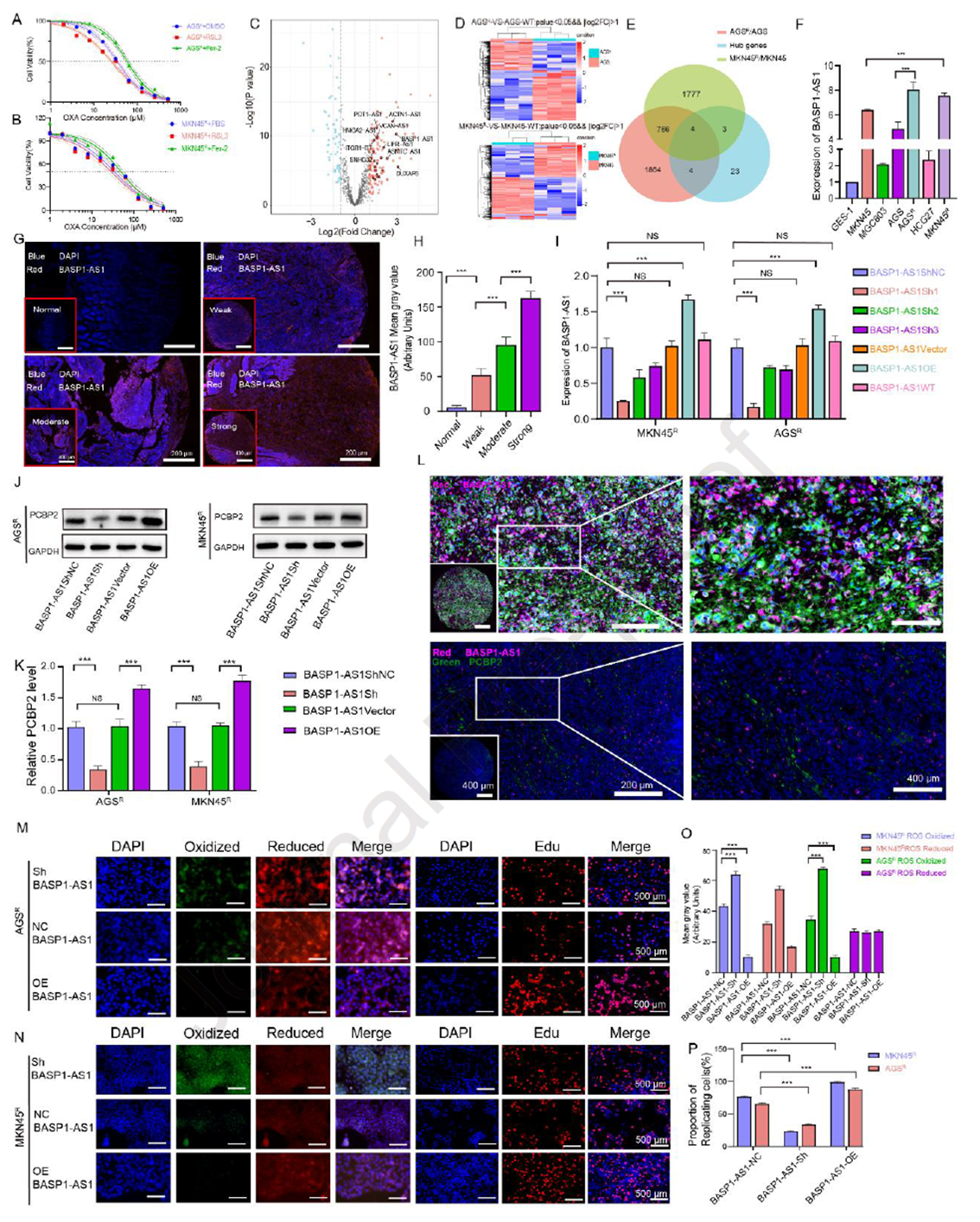
Figure 5. BASP1-AS1抑制鐵死亡并上調(diào)PCBP2表達(dá)
BASP1-AS1激活LDHA依賴的乳酸積累增強PCBP2K115la介導(dǎo)的PCBP2泛素化抑制
研究者進(jìn)一步解析BASP1-AS1調(diào)控PCBP2的分子機制發(fā)現(xiàn),BASP1-AS1不僅影響基因表達(dá),還能重塑細(xì)胞代謝。它讓耐藥細(xì)胞更偏好無氧糖酵解,乳酸水平隨之上升,酸性環(huán)境進(jìn)一步鞏固了耐藥狀態(tài)。當(dāng)抑制糖酵解時,這種優(yōu)勢被削弱。深入分析發(fā)現(xiàn),BASP1-AS1的存在讓PCBP2更容易被乳酰化、逃避降解,從而積累穩(wěn)定。與此同時,負(fù)責(zé)泛素化的ARIH2被“擋”在外面,無法接近PCBP2。追蹤上游機制后,團隊發(fā)現(xiàn)BASP1-AS1能激活ULK1并牽動LDHA,使糖酵解通路全面提速。最終,代謝與表觀修飾在這一鏈條中形成閉環(huán)——BASP1-AS1通過點燃糖酵解引擎,制造乳酸環(huán)境,促使PCBP2保持“被保護”的狀態(tài),從而推動耐藥的形成。
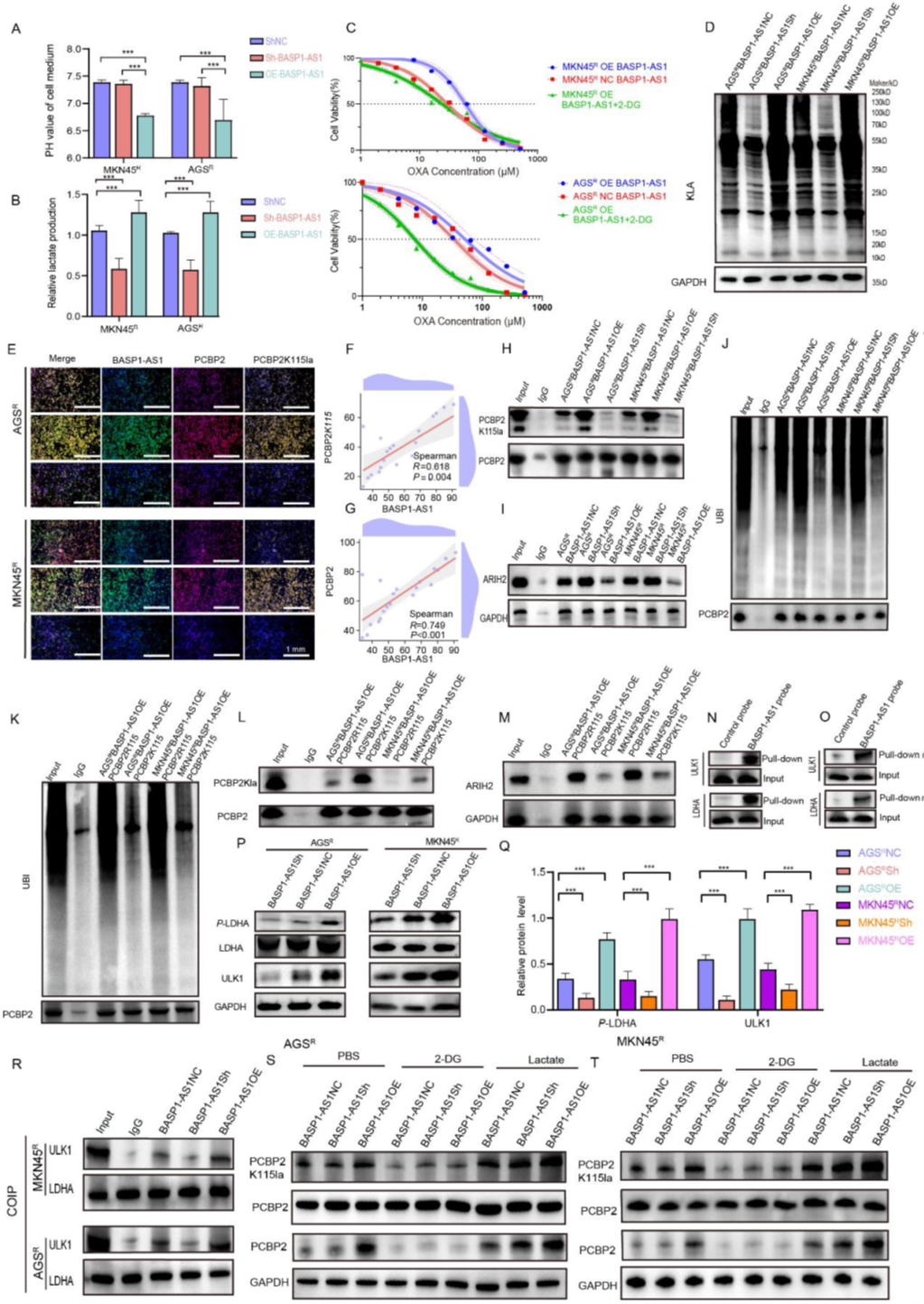
Figure 6. BASP1-AS1激活LDHA依賴的乳酸積累增強PCBP2K115la介導(dǎo)的PCBP2泛素化抑制
BASP1-AS1通過PCBP2調(diào)控通路抑制GC細(xì)胞鐵死亡
在Rescue實驗中,研究者想確認(rèn)BASP1-AS1對OXA敏感性和鐵死亡的調(diào)控,是否真的依賴PCBP2。結(jié)果發(fā)現(xiàn),即使BASP1-AS1被敲低,PCBP2的過表達(dá)仍能提升細(xì)胞內(nèi)的ROS水平,但無法扭轉(zhuǎn)敲低后出現(xiàn)的耐藥下降、增殖受抑和凋亡增加等變化。電子顯微鏡進(jìn)一步顯示,敲低BASP1-AS1的細(xì)胞線粒體結(jié)構(gòu)更致密、功能更活躍,而PCBP2的補償作用依舊有限。綜合來看,BASP1-AS1通過PCBP2相關(guān)但非完全依賴的途徑抑制鐵死亡,從而維持耐藥狀態(tài),這也提示它可能成為突破OXA耐藥的潛在靶點。
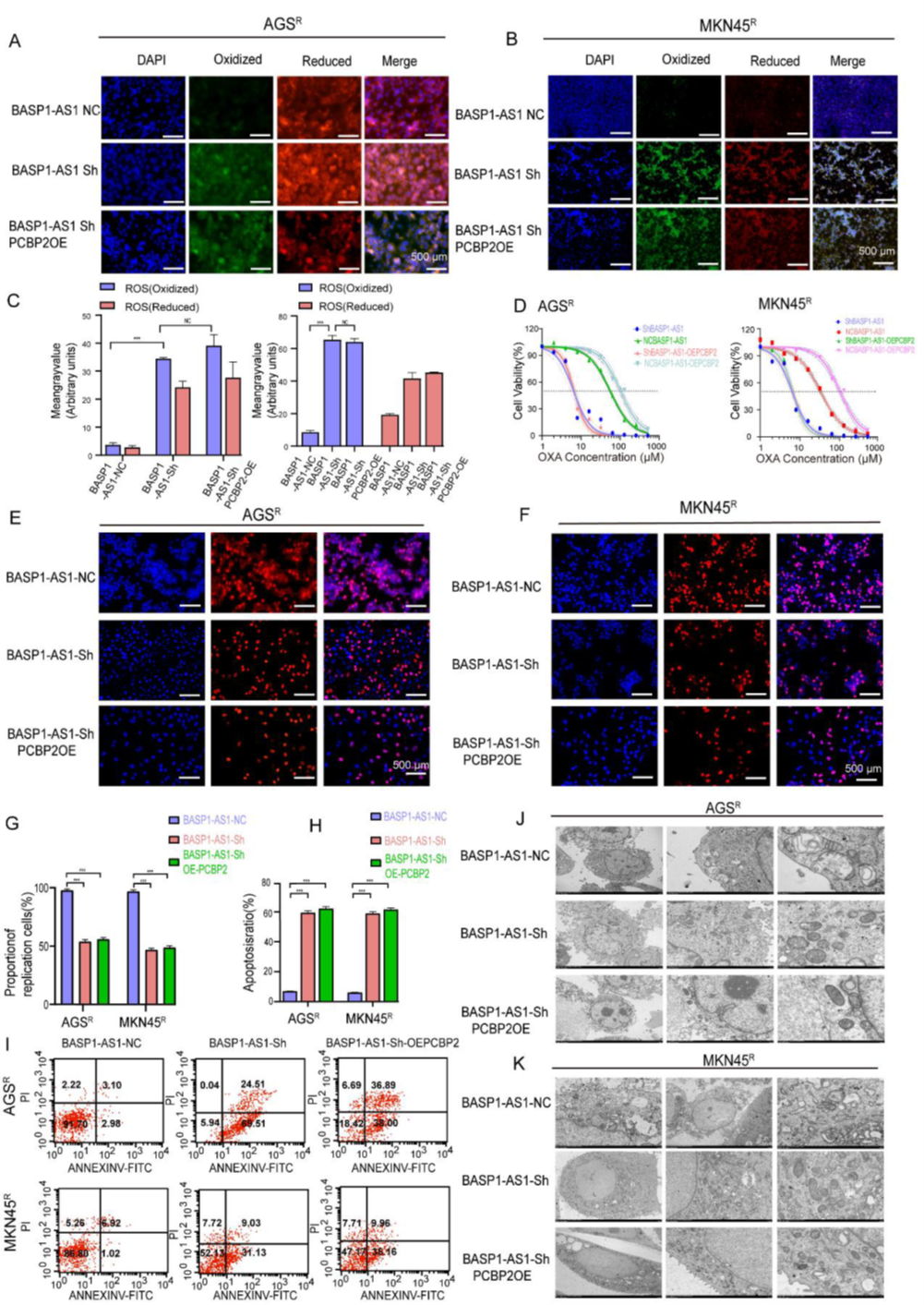
Figure 7. BASP1-AS1通過PCBP2調(diào)控通路抑制GC細(xì)胞鐵死亡
BASP1-AS1激活H3K14la與LDHA依賴的PCBP2K115la建立正反饋
研究者發(fā)現(xiàn),當(dāng)BASP1-AS1被敲低后,細(xì)胞內(nèi)的蛋白乳酰化格局明顯改變,尤其是組蛋白H3K14的乳酰化最為顯著。進(jìn)一步實驗顯示,這一修飾依賴糖酵解產(chǎn)生的乳酸:抑制糖酵解會削弱H3K14乳酰化,而外源乳酸可逆轉(zhuǎn)其下降。Cut&Tag分析揭示,BASP1-AS1改變了H3的結(jié)合模式,使鐵死亡和糖酵解相關(guān)基因(如LDHA與PCBP2)的啟動子區(qū)域被更強地激活。利用 AtaGenix定制的 anti-PCBP2K115la 兔多克隆抗體對關(guān)鍵修飾位點進(jìn)行檢測,研究者進(jìn)一步證實BASP1-AS1通過增強糖酵解促進(jìn)LDHA與PCBP2的轉(zhuǎn)錄,形成“代謝–表觀”正反饋環(huán),進(jìn)一步積累PCBP2乳酰化、抑制鐵死亡并增強OXA耐藥。體內(nèi)實驗中,過表達(dá)BASP1-AS1的小鼠腫瘤對OXA反應(yīng)減弱,而聯(lián)合敲低PCBP2則重新恢復(fù)藥物敏感性,驗證了這一機制的關(guān)鍵節(jié)點。
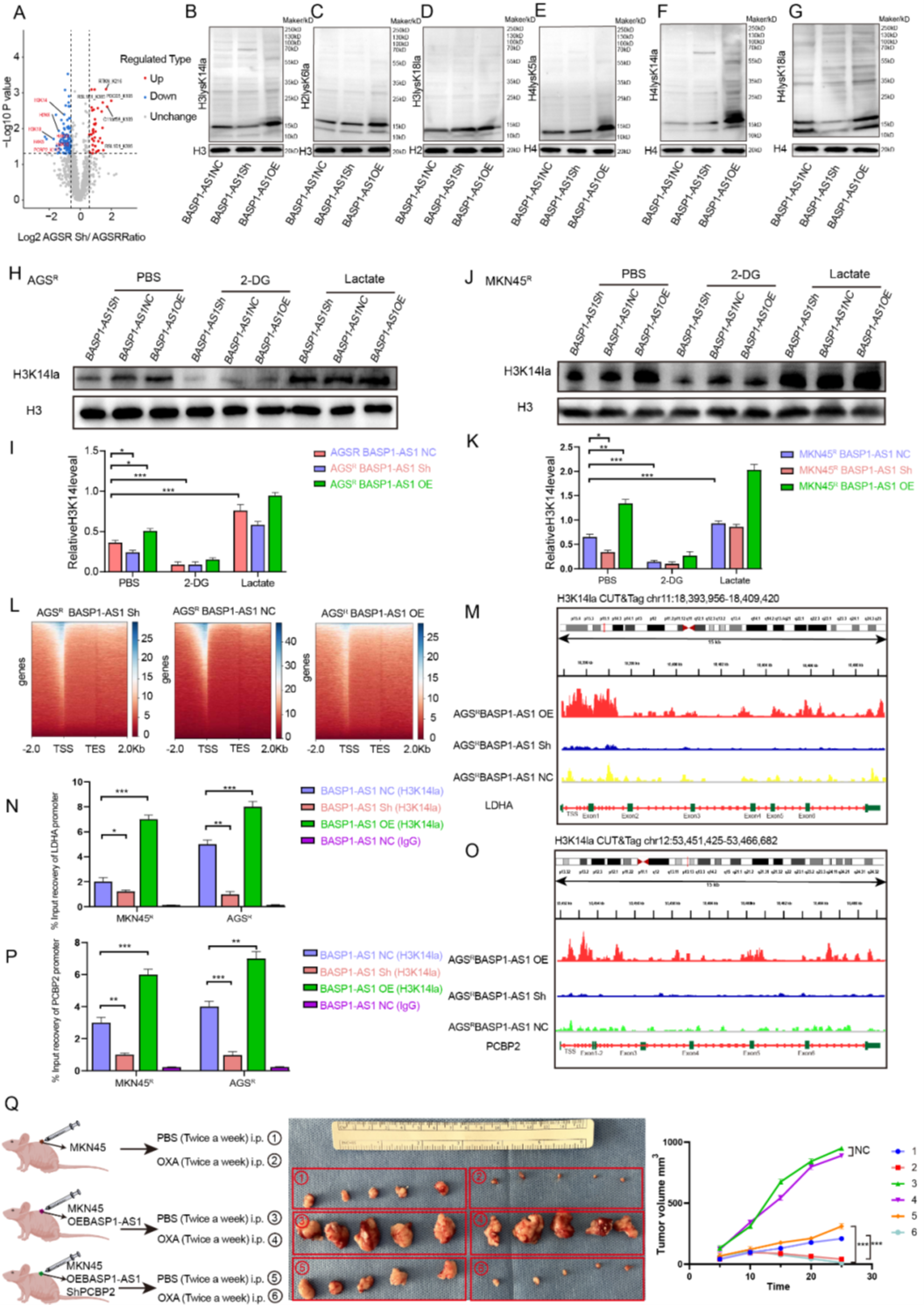
Figure 8. BASP1-AS1激活H3K14la與LDHA依賴的PCBP2K115la建立正反饋
總之,本研究揭示在OXA耐藥GC細(xì)胞中,BASP1-AS1/ULK1/LDHA軸促進(jìn)乳酸產(chǎn)生,誘導(dǎo)PCBP2K115la阻斷ARIH2泛素化穩(wěn)定PCBP2,并通過H3K14la轉(zhuǎn)錄激活LDHA/PCBP2,形成自放大回路。該軸抑制鐵死亡維持耐藥,提示BASP1-AS1–PCBP2通路為GC OXA耐藥的重要分子機制和潛在治療靶點。AtaGenix提供的anti-PCBP2K115la抗體的高特異性使研究能夠精準(zhǔn)追蹤乳酰化水平的動態(tài)變化,從而明確BASP1-AS1調(diào)控PCBP2穩(wěn)定性及OXA耐藥形成的分子基礎(chǔ),為乳酰化修飾在代謝–表觀互作研究中的應(yīng)用提供了有力技術(shù)支撐。
截至2025.10.17,已有400余篇文獻(xiàn)引用了普健生物的一站式蛋白抗體開發(fā)技術(shù)服務(wù)。展望未來,普健生物將繼續(xù)全力支持科研工作,推動技術(shù)創(chuàng)新與突破。為感謝大家的持續(xù)支持,普健生物將一如既往地提供高質(zhì)量的服務(wù),我們的文獻(xiàn)獎勵活動也將長期有效。凡是在發(fā)表的論文中引用普健生物的技術(shù)服務(wù)并標(biāo)注:
中文:普健生物(武漢)科技有限公司
英文:AtaGenix Laboratories Co., Ltd.(Wuhan), Wuhan, PR China
均可獲得專屬獎勵。期待您的參與,共同推進(jìn)科研事業(yè)的發(fā)展。
發(fā)表刊物
SCl期刊雜志
- IF≥15.0:最高3000元普健全系產(chǎn)品抵扣券或最高1500元京東購物卡
- 10≤IF<15:最高3000元普健全系產(chǎn)品抵扣券或最高1000元京東購物卡
- 5.0≤IF<10:最高800元普健全系產(chǎn)品抵扣券或最高600元京東購物卡
- 3.0≤IF<5.0:最高600元普健全系產(chǎn)品抵扣券或最高200元京東購物卡
更多技術(shù)服務(wù)與合作咨詢
歡迎聯(lián)系:info@atagenix.com 或撥打電話 027-87001869 獲取專屬服務(wù)方案。

 聯(lián)系我們
聯(lián)系我們





